دسترسی سریع مطالب
آنزیم های تجزیه کننده پروتئین و نشاسته: بیوشیمی، آنزیم شناسی و خصوصیات مربوط به استفاده در تغذیه دام
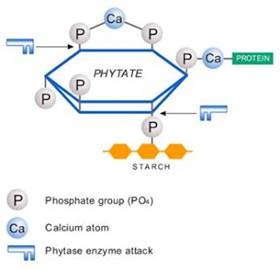
طیور و خوک همه چیز خوار هستند و با توجه به فرصتی که به دست میآورند و دام ها می توانند نیازهای تغذیه ای خود را با مصرف دامنه وسیعی از غلات، دانه ها، ریشه ها، مواد غیر آلی و حشرات تامین نمایند. البته برای اینکه بتوان به سلایق مصرف کنندگان «گیاهخوار» در تولیدات دامی توجه نمود و هزینه های مربوط به تولید تجاری دام را به حداقل رساند، خوراکی که ارائه میشود به ندرت برای سیستم گوارشی حیوان به ویژه برای دام و طیور تازه متولد شده بهینه سازی شدهاند. برای مثال، تجزیه پلی ساکاریدهای غیر نشاستهای (NSP) در برخی از غلات مانند گندم و جو، گرانروی آنها را در لوله گوارشی افزایش میدهد که به مقدار زیادی جذب مواد مغذی را دچار اختلال مینماید. این تاثیر ضدتغذیه ای را میتوان با افزودن زایلانان صنعتی و یا بتاگلوکاناز کاهش داد که به ترتیب پلیمرهای همی سلولز و زایلان و بتاگلوکان را میشکنند. مثال دیگر تجزیه اسید فایتیک میباشد که محل ذخیره فسفات گیاهی میباشد و به آسانی توسط آنزیم های حیوانی تجزیه نمیشود. افزودن فیتاز به غذای دام جدا شدن فسفات از اسید فایتیک را تضمین نموده و بنابراین میتواند بخشی از یا کل نیازهای دام به فسفر را پوشش دهد بنابراین در برخی از مثالها آنزیمهای برونزا میتوانند خلا بین ترکیب مواد غذایی و مکمل های آنزیمی گوارشی خود حیوان را پر نمایند. با این حال، اگرچه هم طیور و هم خوک قادر به تولید مقادیر چشمگیری از آمیلاز و پروتئاز هستند اما هنوز فرصتی موجود خواهد بود تا بتوان این سیستمها را از طریق استفاده از آنزیم های برونزا تقویت نمود. هدف این فصل بررسی آنزیمهای برونزای تجزیه کننده نشاسته و پروتئین در زمینه تغذیه دام میباشد. نشاسته از دو پلیمر آمیلوز و آمیلوپکتین تشکیل میشود. هر دو این پلیمرها از واحدهای گلوکز (گلوکوپیرانوزیل) تشکیل میشوند که به واسطه پیوندهای آلفا۴،۱-گلوکوسیدیک به هم متصل میشوند. آمیلوز اساساً یک پلیمر خطی با تعدادی شاخه میباشد که با پیوندهای آلفا ۶،۱-گیکوسیدیک به هم متصل میشوند. اندازه پلیمر آمیلوز به طور قابل توجه ی تغییر میکند و میتواند میزانی از پلیمری شدن (DP) تا ۶۰۰ واحد گلوکز داشته باشد. اما آمیلوپکتین در مقایسه، به شدت شاخه دار است و از زنجیره های گلوکز تشکیل شده است که عمدتاً به واسطه پیوند الفا-۱، ۴-و با آلفا-۱، ۶ در نوک شاخه ها به هم متصل میشوند. زنجیره های کوتاه با میزان پلیمری شدن متوسط ۱۸-۱۴ گلوکز، زنجیرههای بلند با میزان پلیمری شدن ۵۵-۴۵ گلوکز و زنجیره های خیلی بلند با میزان پلیمری شدن بیش از ۶۰ گلوکز. زنجیرههای جانبی آمیلوپکتین به صورت مارپیچ آلفا درمیآید که خود را به صورت ساختار فشرده نیمه متبلور آرایش میدهند. این خوشه های آمیلوپکتینی همراه با آمیلوز تشکیل ریز دانه های نشاسته را میدهند که از نظر اندازه و شکل بسته به منشا نشاسته متفاوت هستند. نشاسته همچنین میتواند با توجه به میزان سادگی هضم آن طبقه بندی شود: که به صورت نشاسته با زمان هضم اندک؛ نشاسته با زمان هضم نسبتاً زیاد؛ و نشاسته مقاوم در برابر هضم . این مقادیر را میتوان در محیط آزمایشگاه بدست آورد . نشاسته مقاوم در برابر هضم به ویژه در تغذیه دام اهمیت پیدا میکند چون این نوع نشاسته از هضم شدن در روده جان سالم بدر می برد. نشاسته مقاوم به هضم به صورت جزئی یا کلی با تخمیر به وسیله میکروفلورا تجزیه شده و تشکیل اسیدهای چرب کوتاه زنجیر و گازهای مختلف را میدهند. این نوع نشاسته را میتوان در مرحله بعدی طبقه بندی بنابر دلایل مقاومت در برابر هضم نیز دسته بندی کرد: الف. نشاسته غیر قابل دسترسی فیزیکی (RS1) به واسطه ذخیره شدن آن در دانه های آسیاب نشده؛ ب. نشاسته خام (RS2) به صورت دانه هایی که چنان فشرده هستند که زمان هضم آنها از زمان عبور آنها از لوله گوارشی بیشتر است؛ یا ج. نشاسته پسرونده (رتروگرید شده) (RS3) که هنگامی تشکیل میشود که نشاسته ژلاتینی پخته شده و با گذشت زمان به صورت بلورهای غیر قابل تجزبه درمیآید. نشاسته ژلاتینی هنگامی تشکیل میشود که نشاسته را تا بیش از ۶۰ درجه سانتیگراد در محیط آبی حرارت دهیم . این دما به نوع دانه های نشاسته بستگی دارد اما عموماً بین ۶۵ تا ۷۰ درجه سانتیگراد برای گندم و ذرت با مقدار زیاد آب میباشد. هنگامی که مواد غذایی دام را به وسیله خرد کردن فرآوری نماییم، هم گرما و هم رطوبت به آن اضافه میشود. در طول این فرایند میزان آب عموماً فقط بین ۲۰ تا ۳۰ درصد است درحالیکه دما تا حداکثر ۱۰۰ درجه و در مواردی تا ۱۲۰ درجه سانتیگراد افزایش داده میشود. این شرایط فیزیکی برای ژلاتینی شدن برای مقادیر زیاد نشاسته خام کافی نخواهد بود چون مقدار آب نیز به شدت پایین میآید، و در این شرایط تنها نشاسته خرد شده (در طول آسیاب مواد خام) به طور موثری ژلاتینی خواهد شد. مطابق با این امر، Svihus و همکاران نشان دادند که در شرایط استاندارد خرد سازی نشاسته حداکثر ۲۰-۵ درصد از کل نشاسته ژلاتینی خواهد شد و Eerlingen و همکاران نشان دادند که فقط بخش حداقلی از نشاسته ژلاتینی شده در شرایط ذخیره سازی استاندارد به نشاسته معمولی بازگشت خواهد کرد. نشاسته تجزیه شده توسط آنزیمهای موجود در روده باریک (یعنی قبل از رسیدن به روده بزرگ که در آن تجزیه میکروبی آغاز میگردد) به تولید محصول نهایی گلوکز منجر میشود که به طور مستقیم از طریق لایه اپیتلیال روده جذب میشود. البته از نشاسته تجزیه شده به وسیله میکروبها فقط کسری از انرژی حاصل از آن از طریق تشکیل و جذب اسیدهای چرب کوتاه زنجیر تولید شده از تخمیر میکروبی در دسترس حیوان خواهد بود. این امر نشان میدهد که نشاسته با هضم آسان به طور موثرتری از نشاسته مقاوم در برابر هضم، که توسط جمعیت میکروبی پرزهای روده تحزیه میشوند، قابل استفاده خواهد بود. مثلاً De Schrijver و همکاران نشان دادند که هم موشهای آزمایشگاهی و هم خوک های تغذیه شده با نشاسته مقاوم به هضم در مقایسه با همنوعان خود که با نشاسته با قابلیت هضم آسان تغذیه شده بودند دارای انرژی قابل هضم ظاهری کمتری در بخش آخر روده باریک هستند حتی هنگامی که مقدار نشاسته مقاوم در برابر هضم فقط ۶ درصد از کل جیره را تشکیل میداد. چند خانواده از آنزیمها برای تجزیه نشاسته وجود دارند. آنزیمهای تجزیه کننده آمیلوز از نظر ساختار به خانوادههای گلوکوسید هیدرولاز (GH) تعلق دارند. مهمترین خانواده GH 13 میباشد که شامل آلفاآمیلازهای اختصاصی درونی (EC 3.2.1.1) میباشد که محلهای پیوند داخلی ۱، ۴ را در زنجیرههای آمیلوز یا آمیلوپکتین و پولولانازها (EC 3.2.1.41) را میشکند که قادر به هیدرولیز نقاط شاخه سازی ۱، ۶ در آمیلوپکتین میباشند. GH 15 دارای آمیلوگلوکوسیداز یا گلوکوآمیلاز اختصاصی بیرونی (EC 3.2.1.3) میباشد که زنجیرههای آمیلوز یا آمیلوپکتین را از انتهای غیر کاهشی میشکند و هر بار یک واحد گلوکز آزاد میکند. علاوه بر اینها، انواع مختلفی از آمیلازهای اختصاصی بیرونی مانند بتاآمیلازها (EC 3.2.1.2، متعلق به GH 14) و مالتوتترائوهیدرولازها (EC 3.2.1.60، متعلق به GH 13) وجود دارند که به انتهای غیر کاهشی حمله میکنند و چند پلیمر متشکل از به ترتیب دو و چهار گلوکز را آزاد میکنند. در تغذیه دام سیستم گوارشی حیوان چند نوع آمیلاز را تولید میکند . آلفاآمیلازهای بزاق (GH 13, EC 3.2.1.1) که در دهان ترشح میشود تجزیه نشاسته را به محض بلع غذا شروع میکنند. آلفاآمیلاز لوزالمعدهای (GH 13, EC 3.2.1.1) در لوزالمعده برونریز تولید شده و به دوازدهه ترشح میشود که در آن نشاسته قابل دسترس تجزیه شده و گلوکز، پلیمرهای گلوکز و دکسترینها (واحدهای گلوکز همراه با و یا احاطه کننده پیوندهای گلیکوسیدی آلفا-۱، ۶-) تولید می شوند. گلوکز میتواند مستقیماً از سلولهای پوششی روده جذب شود، در حالیکه محصولات دیگر تجزیه بایستی یک مرحله از شکسته شدن را به وسیله فعالیت مالتازی و ایزومالتازی (EC 3.2.1.3 و ۳٫۲٫۱٫۵۲) حاضر در پرزهای جاروب کننده پوشش روده تجربه کنند. بعد از آن، گلوکز آزاد شده جذب میگردد. پروتئینها از پلیمرهای اسید آمینه تشکیل میشوند. تمامی اسیدآمینه ها عموماً از یک گروه آمینو و یک گروه کربوکسیل تشکیل میشوند که آمینواسید را به پپتیدها متصل میکند که استخوانبندی پروتئین ها را تشکیل میدهد. هر آمینو اسید به علاوه یک گروه جانبی نیز دارد که دارای خواص شیمیایی مختلف است و اساس گروهبندی اسیدهای آمینه به آب گریز، آب دوست یا معطر (آروماتیک) میباشد. ترکیب بخصوص و ترتیب آمینو اسیدها در پرتئین همراه با ساختار سه بعدی خصوصیات نهایی پروتئین ها را شکل میدهند. آنزیمهایی که پروتئین ها را میشکنند یعنی پروتئازها به واسطه توانایی شان در آبکافت پیوندها قبل و بعد از اسید های آمینه بخصوصی شناخته میشوند. پروتئازهای شرکت کننده در تجزیه پروتئین در سیستم گوارشی به صورت وسیعی هم در دام و هم در انسان مورد ارزیابی قرار گرفته اند . البته، در این مورد اخیر خوک اغلب به عنوان مدلی برای درک گوارش انسانی استفاده شده است. عموماً، فعالیتهای پروتئازهای درونزا به صورت دقیقی تنظیم میگردد زیرا فعالیت آنان در محلهای نامناسب میتواند به گوارش و جذب بافتهای خود حیوان منجر شده و یا مسیرهای واکنش التهابی را فعال نماید. سلولهای بافت پوششی لوله گوارشی خوک (و انسان) و معده طیور پپسینوژن ترشح میکنند که ماده پیش ساز پپسین میباشد (EC 3.4.21.4). پپسینوژن به لوله گوارشی ترشح میشود و در محیط اسیدی توسط پپسین فعال میگردد. پپسین یک پروتئاز درونی است که پیوندهای پپتید دارای فنیل آلانین، تیروزین، و لوسین را در دامنه pH 3.5-1.8 میشکند . پپسین بخصوص در هضم ماهیچه، تاندونها، و سایر بخشهای گوشت دارای کلاژن بالا مفید است. پپسین مرغی در شرایط اسیدی کمتری از پپسین خوکی و انسانی فعال است و در شرایط pH اندکی بازی به صورت برگشت ناپذیری غیر فعال میگردد . لوزالمعده منبع اصلی پروتئازها در لوله گوارشی است. بسیار از پروتئازها به صورت پیش آنزیمهای غیر فعال مانند پپسینوژن ساخته میشوند. این پروتئازها شامل کیموتریپسینوژن، تریپسینوژن، پروالاستاز و پروکربوکسی پپتیدازها میباشند. این پیش آنزیمها به وسیله پروتئاز تریپسین فعال میشوند. تریپسین (EC 3.4.21.4)، کیمو تریپسین (EC 3.4.21.1) و الاستاز (EC 3.4.21.36) پروتئازهایی با منشا خانواده پروتئاز سرین میباشند. تریپسین پپتیدهای دارای اسیدهای آمینه پایه (لایزین و آرژنین) را تجزیه میکند، کیموتریپسین اسکلت پروتئین را در محل پیوند اسیدهای آمینه اروماتیک (فنیل الانین، تریپسین و تریپتوفان) میشکند و الاستاز در محل اسیدهای آمینه بدون بار الکتریکی کوچک (مانند آلانین، گلیسین و سرین) را تجزیه میکند . همه این پروتئازهای داخلی الیگوپپتیدهای کوچک را ترشح میکنند که در مرحله بعد به وسیله کربوکسی پپتیدازهایی مانند کربوکسی پپتیداز A (EC 3.4.17.1) و کربوکسی پپتیداز B (EC 3.4.17.2) تجزیه میشوند. این پپتیدازهای خارجی الیگوپپتیدهای آزادکننده اسیدهای آمینه آزاد را تجزیه میکنند و آنرا برای جذب توسط حیوان آماده میسازند. علاوه بر پپسین و پروتئازهای لوزالمعده، انتروسیتهای روده باریک چندین نوع آمینوپپتیداز (EC 3.4.11.1 ,EC 3.4.11.2 ) و کربوکسی پپتیدازها را تولید میکنند که بیشترین تاثیر را در هضم پپتیدهای کوچک بعد از شکسته شدن اولیه پروتئین های مرکب توسط پروتئازهای لوله گوارشی و لوزالمعده دارند. آمیلاز عمده به کار رفته در تغذیه دام آلفاآمیلاز بدست آمده از باسیلوس آمیلولیکفاسینز (BAA). این آمیلاز بشدت تجزیه کننده است یعنی پلیمرهای نشاسته را به الیگومرهای سازنده آن تجزیه میکند. محصولات اولیه هیدرولیز بدست آمده مالتوتریوز (DP 3) و مالتوهگزائوز (DP 6) میباشند . این آمیلاز همچنین ثبات دمایی نسبتاً بالایی داشته که احتمال بقا آنرا بعد از خرد شدن مواد غذایی بالاتر میبرد. در مقایسه، زمانی که نشاسته توسط الفاآمیلازهای لوزالمعده خوک (PPA) تجزیه میشود محصولاتی مانند گلوکز تا مالتوترائوز (DP 1-4) و همچنین دکسترینهای دارای محدودیت آلفایی با دو محل اتصال الفا-۶-۱ تشکیل میشوند. تجزیه اولیه آمیلوپکتین توسط BAA و PPA متفاوت است. در مورد BAA احتمال شکستن پیوندهای زنجیرهای داخلی بالاتر از PPA میباشد . بنابراین BBA در شکستن آمیلوپکتین به ملکولهایی با اندازه کوچک سریعتراز PPA عمل میکند، درحالیکه PPA زنجیره های آمیلوپکتین را به صورت یکسانی کوتاه میکند. در یک میزان تجزیه ۱۰ درصدی نشان داده شد که BAA عمدتاً DP 6-10 را تولید میکند درحالیکه PPA عمدتاً DP 2-4 را فراهم میسازد . براساس این تفاوتها در عمل، احتمال بیشتری وجود دارد که BAA اضافه شده به PPA میزان تجزیه آمیلوپکتین (و نیز آمیلاز) به مالتو الیگوساکاریدهای کوتاهتر را افزایش دهد که میتوانند به سرعت برای تشکیل گلوکز توسط مالتاز و ایزومالتاز و جذب آن در سلول های پوششی دستگاه گوارشی تجزیه شوند. میزان مفید بودن آمیلازهای برونزا درتغذیه خوک و طیور هنوز به صورت روشنی ثابت نشده است. البته چندین نظریه وجود دارد که نشان میدهند که آمیلازهای برونزا ممکن است نقشی در افزایش تولید لوزالمعدهای نابهنگام در حیوانات تازه متولد شده یا در کمک به حیوان در مواردی که نشاسته در برابر هضم مقاوم باشد، داشته باشند. Gracia و همکاران نشان دادند که آمیلاز برونزا قادر به تقویت عملکرد جوجه های تغذیه شده با جیره ذرت-سویا است. بعلاوه، آمیلاز مکمل نیز هضم نشاسته و مواد آلی را تقویت ساخت که مربوط به AME (انرژی قابل متابولیسم ظاهری) بهتر میباشد. این تاثیرات مفید مستقل از سن پرنده بودند (و توسط تحلیل عاملی ثابت شد) که نشان میدهد که این فقط حیوانات تازه متولد شده نیستند که میتوانند از استفاده از آنزیم های تجزیه کننده نشاسته سود ببرند. گرچه انرژی قابل متابولیسم ظاهری بهتر و هضم پذیری نشاسته توسط گارسیا و همکاران گزارش شدند، بهبود چشمگیر در عملکرد (حدود ۹ درصد افزایش وزن بدن و ۵ درصد افزایش تبدیل غذایی) نمیتواند به تنهایی با استفاده از تقویت میزان هضم مواد غذایی توضیح داده شوند. در واقع تاثیر آمیلاز بر انرژی قابل متابولیسم ظاهری در این پژوهش بخصوص نسبتاً در حد متوسط ۸۰-۵۰ کیلوکالری در هر کیلوگرم وزن بدن بوده است. کمبود برهمکنش بین سن حیوان و افزودن آمیلاز به جیره و تناقض ظاهری بین عملکرد و تقویت میزان هضم پذیری نشان میدهند که آمیلاز برونزا میتواند تاثیرات فیزیولوژیکی داشته باشد که به سادگی توسط آزمایشهای متعارف بازیابی مواد غذایی شناسایی نشوند. این امر به طور آموزندهای نشان میدهد که استفاده از آمیلاز به طور چشمگیری حجم لوزالمعده را بدون تاثیرگذاری بر سایر اندامها کاهش داد که نشان میدهد که هضم آمیلاز به صورت بخشی از ماتریکس تغذیه ای میتواند تاثیرات ترشحی مهمی را باعث شود که شاید کاهشی در میزان تولید آمیلاز بوده باشد. البته این بحث در ادبیات موضوع حمایت حداکثری کسب نکرده است. Ritz و همکاران نشان دادند که در بوقلمون ها آمیلاز برونزا عمدتاً به صورت افزودن آمیلاز درونی بود که بازخورد ترشحی محدودی را ممکن مینماید. این امر ممکن است که ماهیت آمیلاز تغذیه شده یعنی برابری با سیستمهای لوزالمعده یا پرزهای جاروب کننده پوشش روده تجزیه کننده نشاسته، خصوصیات خود جیره یا گونه و سن حیوان مسئول این نتایج متناقض میباشند. در واقع تاثیر بازدارندگی آمیلاز برونزا بر تولید درونزای آن در جوجه ها اخیراً توسط Jiang و همکاران ثابت شده است که طی ان آمیلاز مکمل بیان mRNA لوزالمعده را در جوجه های تغذیه شده با جیره با پایه ذرت-سویا کاهش داده بود. میزان تاثیر مخلوطهای آنزیمی شامل پروتئاز به صورت وسیعی گزارش شده است اما تنها در تعداد اندکی از آزمایشها تاثیر پروتئاز مکمل به صورت مستقل از افزودن مخلوط آنزیمی گزارش شده است. Yu و همکاران تاثیر افزودن پروتئاز را در یک طرح آزمایشی طیور بررسی کردند که در آن هم جیره متعارف و هم جیره دارای پروتئین خام پایین ذرت-سویا استفاده شد. در محیط آزمایشگاهی پروتئاز تجزیه پروتئین سویا را در مدل شبیه ساز دستگاه گوارشی تقویت نمود درحالیکه نه ماهی و نه ذرت چنین تاثیری نپذیرفتند. این تاثیرات در آزمایشهای تغذیه ثابت شده اند که در آن طیور پروتئاز دریافت کردند جیره مکمل بهبود عددی در میزان وزن بدن در طول کل دوره رشد (۰ تا ۳۸ روزگی) و کاهش چشمگیر در ضریب تبدیل غذایی نشان داد. علیرغم این، هیچ بهبودی در میزان هضم ظاهری پروتئین و ماده خشک در کل دستگاه گوارش مشاهده نشد. البته همچنانکه پژوهشگران نیز اذعان دارند داده های اخیر دارای ارزش محدودی هستند زیرا در تحلیل مدفوع حیوانی نقش میکروفلورا چشمگیرتر میشود. Thacker بهبود چشمگیری در ضریب تبدیل غذایی را دریافت هنگامی که پروتئاز به جیره با پایه گندم اضافه شد. جالب است که وی هیچ تاثیر قابل توجه ی در میزان هضم ماده خشک، هضم انرژی یا بازجذب نیتروژن ناشی از پروتئاز مکمل را بدست نیاورد. متاسفانه، در این پژوهش فقط میزان هضم در کل دستگاه گوارش مورد بررسی قرار داشت. این دو آزمایش میتواند تاثیری بغیر از بهبود تجزیه پروتئین در دستگاه گوارش را نشان دهد ممکن است تاثیری مشابه تاثیر بازدارندگی وجود داشته باشد، همچنانکه در مورد افزودن آمیلاز گفته شد، اما این بحث به طور مستقیم مورد تایید قرار نگرفته است که بخشی ناشی از تعداد اندک آزمایش هایی است که در آنها پروتئاز به صورت جداگانه به جیره اضافه میشود. Peek و همکاران تاثیر جیره ذرت-گندم-سویا با مکمل پروتئاز را بر جوجه های مبتلا به آیمریا اس پی پی (Eimeria spp.) بررسی کرده و دریافتند که افزودن پروتئاز به صورت مکمل به جیره تاثیر منفی آلودگی کوکسیدیوزی بر افزایش وزن جوجه ها داشت. مکانیسمهای این تاثیر هنوز ناشناخته مانده اگرچه زخم های تجربی کوکسیدی و دفع اووسیت تاثیری نپذیرفتند و لایه موسین در جوجه های دریافت کننده پروتئاز به طور معناداری زخیم تر بود. در نهایت، Ghazi و همکاران تاثیر پروتئاز خارجی را بر ازرش غذایی سویا در جوجه ها و جوجه خروس ها بررسی کردند. در این پژوهش تفاوتهایی بین پروتئازها وجود داشت و بیشترین تاثیر زمانی مشاهده شد که پروتئاز اسیدی اسفنج مورد استفاده قرار گرفت. این داده ها نشان میدهند که ممکن است گاهی تفاوتهایی بین پروتئازهای مکمل وجود داشته باشد اگرچه سری دادهها برای اینکه نتیجه گیری معناداری بگیریم به قدر کافی زیاد نیستند. برخی از حالات بالقوه در توضیح تاثیرات مفید پروتئازها در جیره طیور پیشنهاد شده اند. پروتئازها میتوانند تولید برونزای پپتید را افزایش داده و نیاز به اسیدهای امینه و انرژی را کاهش دهند یا قابلیت هضم پروتئین جیره را تقویت نمایند. به علاوه، پروتئازها میتوانند مواد غیر مغذی مانند مهارکننده های با پایه پروتئینی لکتین ها و تریپسین ها را تجزیه نموده و بهره وری استفاده طیور از اسیدهای آمینه را افزایش و بازگشت پروتئین را کاهش دهند. البته نبود دانش قابل توجه هنوز در مورد حالات عمل پروتئازهای برونزا، تفاوتهای بین دسته های مختلف پروتئازها (مانند pH بهینه، مکانیسمها و سوبسترای ترجیحی) و نیز کاربرد آنها در تغذیه دام هم به صورت جداگانه (که بندرت اتفاق میافتد) و چه بیشتر به عنوان بخشی از ترکیب آنزیمی (مانند زایلاناز، فیتاز، گلوکاناز و آمیلاز) ادامه دارد . بنابراین برای اثبات درستی یافته های پیشین که نشان میدهند که پروتئاز برونزا میتواند به عنوان طرفداری مفید در تغذیه دام باشد توصیه میشود که پژوهش های بعدی برای روشن ساختن مکانیسم عمل، مقدار بهینه، نوع بهینه پروتئاز و سوبسترای مطلوب و نیز برای بررسی برهم کنشهای بین پروتئاز و سایر مکمل ها و سیستمهای آنزیمی برونزا انجام شوند. ترکیب جیره میتواند فیزیولوژی سیستم گوارشی را تحت تاثیر قرار دهد. مثلا Starck 33 نشان داد که یک افزایش-کاهش برگشت پذیر در اندازه اندامهای گوارشی همراه با تغییر در میزان فیبر جیره در بلدرچین ژاپنی وجود دارد. این مطالعه در قفسهایی انجام گرفت اما تغییرات مشابهی بر پژوهشها روی پرندگان در محیط وحش مثلا در نوک دراز آبی دم نواری مشاهده شده است. اگرچه دام های مزرعه در معرض چنین تغییرات شدید تغذیه ای نیستند قابلیت بالقوه برای سازگاری تغذیه ای میتواند وجود داشته باشد. Corring 35 ثابت کرد که جیره بر برونداد و ترکیب پانکراتین در بین جوجه های گوشتی را تحت تاثیر قرار داد . جذب غلظت های زیادی از پروتئین نسبت به کربوهیدرات ترکیب پانکراتین را به نفع آنزیمهای پروتئولیزی تغییر میدهد و این امر میتواند به سرعت برعکس شود اگر جذب به نفع نشاسته تغییر جهت داهد. تغییرات در ترشح پانکراتین ناشی از جیره نیز در خوک های در حال رشد توسط Makkink and Verstegen و Jakob و همکاران نشان داده شده است. جالب توجه است که بدانیم که افزایش غلظت فیبر خام ناشی از افزودن سبوس گندم در جیره به افزایشی در میزان مایع ترشحی لوزالمعده ای منجر شد درحالیکه همان تاثیر با افزایش سلولوز خالص مشاهده نشد. این راهکارهای سازگاری در تغذیه دام و طیور به طور کلی شهودی هستند و نشان میدهند که فرایند گوارش با دقت تنظیم میگردد تا اطمینان حاصل شود که تولید مازاد و خام مایعات گوارشی نامناسب اتفاق نمیافتد. این امر فرصتی را برای به حداقل رسانی تولید درونزا به واسطه تغذیه آنزیم های مختلف برونزا را فراهم میسازد که لزوماً تقویت عملکرد به واسطه افزایش ضریب قابلیت هضم نبوده بلکه با به حداقل رسانی منابع ترشحی ممکن میگردد. این کاهش برونزاد مثلا آنزیم های موسینها یا آنزیم های گوارشی میتواند به تقویت مطلوبیت تام مواد مغذی جذب شده منجر شود؛ البته نیز نمیتواند به تغییرات در قابلیت هضم رودهای یا کل مجاری گوارش مربوط باشد. در واقع، Souffrant و همکاران نشان دادند که در خوک ها مقادیر قابل توجه نیتروژن با منشا خارجی در اخر روده بازیابی میشود و حتی در کل دستگاه گوارشی این مقدار بیشتر است (بیشتر از ۸۰ درصد)، گرچه پژوهشگران اعتراف کردند که نیتروژن بازیابی شده در روده بزرگ دارای ارزش فوری برای حیوان نیست. با اینحال، این امر ممکن است که ارزش واقعی آمیلاز و پروتئاز مکمل در عمل کاهش احتیاجات انرژی نگهداری سیستم گوارشی (احتیاجات اسید آمینه) بوده و در تقویت انرژی قابل هضم رودهای نباشد. اگر آمیلازها و پروتئازها بخش قابل توجهی از فواید خود را به صورت غیر مستقیم ارائه میکنند بنابراین میتوان انتظار داشت که فواید مشاهده شده برای مواد مغذی درگیر در تولید، ترشح و بازیابی آمیلاز و پروتئاز مشهودتر باشد. به علت اینکه طیور دارای آمیلاز بزاقی نیستند، این فواید نمیتواند دیده شود تا زمانیکه بخش لوزالمعدهای روده کوچک و بنابراین تولید موسین شکمبه ای و پیش ساز آنزیم تاثیری نپذیرند. از طرف دیگر، مزایای آمیلاز مثلاً برای قابلیت هضم اسیدهای آمینه رودهای در واقع به خوبی با ترکیب اسیدآمینه آمیلاز لوزالمعدهای (مالتاز یا ایزومالتاز پرزهای جاروب کننده پوشش روده) هماهنگی داشته باشد. Corring and Jung ترکیب اسید آمینه آمیلاز لوزالمعدهای خوک را ارائه کرده و دریافتند که این ترکیب دارای اسید آسپارتیک، گلوتامیک، لوسین و سرین قابل توجه ی میباشد. بنابراین ممکن است که دخالت دادن یک آمیلاز با منشا خارجی بتواند مزایای ویژهای را به میزبان این اسید آمینه ها به روشی داشته باشد که برای مزایای غیر مستقیم پپسین و موسین در مورد فیتازها نشان داده شده است، یعنی تاثیرات مفیدی که با ترکیب پروتئینهای با منشا داخلی هماهنگی دارد . در واقعیت آمیلازها و پروتئازها بندرت به صورت جداگانه توسط دام تغذیه میشوند و بیشتر به عنوان بخشی از مخلوط آنزیمی میباشند که شامل زایلانازها، گلوکانازها، پروتئازها و فیتازها میباشد. اخیراً نشان داده شده است که میزان کارایی چنین آنزیمهایی به طور مطلقی با میزان قابلیت هضم جیره ای در وابسته است که آنها به آن اضافه شده اند. به علت اینکه بیشینه قابلیت هضم رودهای نظری (و نه واقعی) ۱۰۰ درصد است، مواد پیش مغذی تقویت کننده هضم پذیری به صورت مداومی قابلیت هضم را به یک خط مجانب ثابت هدایت میکند بنابراین فرصت تقویت بیشتر با هر افزودن جدید کاهش می یابد. در واقع، این امر اخیراً برای میزان همکاری بین زایلاناز و گلوکاناز و افزایش پذیری مقدار زمینه زایلاناز و فیتاز ثابت شده است. بنابراین در هنگام تنظیم مخلوطی از آنزیمها رعایت حد میانه توصیه میشود و این امر غیر محتمل است که اثرات مفید آمیلاز به طور کلی حضور سایر افزودنیهای محرک رشد هیچ تاثیری نپذیرد. با این حال، از ادبیات اندک واضح است که آمیلازهای با منشا خارجی میتوانند در تقویت عملکرد موثر باشند و با این عمل، یک عامل قابل توجه در تنظیم مخلوط آنزیمی برای تک معدهایها باشد. البته این واقعیت که مزایا بیش از آنکه قابل متابولیسم باشند، خالص هستند، یک مسئله بغرنجی است که به طور کافی به آن پرداخته نشده است. تا زمانیکه متخصصین تغذیه دام و طیور بر اساس یک پایه خالص به جیره نویسی ادامه میدهند، ارزش دهی مناسب به این آنزیمها به وسیله زمینه تغذیه ای قابل فهم دشوار خواهد بود. میتوان نتیجه گرفت که آمیلازهای برونزا و شاید نیز پروتئازها در تغذیه دام ، خوک و طیور مفید باشند اما اینکه این تاثیر چگونه با پیش مغذی هایی مانند فیتازها، زایلانازها، آنتی بیوتیک های محرک رشد و غیره هم افزایی دارند هنوز مشخص نیست. دخالت های راهبردی در یک سطح ترشحی یک امر ممکن است و مزایای آن میتواند دارای ابعادی بزرگتر از تقویت ناچیز در بازیابی روده ای انرژی باشد اما پژوهش های بیشتری برای درک چگونگی واکنش تغذیه دام به موادی که تغذیه میکند لازم است. M.F. ISAKSEN, A.J. COWIESON AND K.M. KRAGH مقدمه
آنزیم های تجزیه کننده نشاسته و پروتئین
نشاسته
آمیلوپکتین از سه نوع زنجیره تشکیل میشود
آنزیم های تجزیه کننده نشاسته
پروتئین و پروتئازها
تاثیر آنزیم های برونزای تجزیه کننده نشاسته در خوک و طیور
میزان تاثیر پروتئازهای برونزا درتغذیه دام ، خوک و طیور
مکانیسم عمل آمیلاز و پروتئاز برونزا




سلام خسته نباشید، آنزیم زایلاناز موجود دارید؟
سلام ، تشکر .
نه شرکت آنزیم فیتاز ۱۰۰۰۰ را از شرکت بیوشم آلمان وارد می کند که آن هم فعلا(۱۳۹۸۱۱۲۸) ترخیص نشده است.
سلام
خانوادهGH13چیست؟
سلام وقت به خیر
مفهوم آن در مطلب هم ذکر شده است که اشاره دارد به آلفاآمیلازها
سپاس از همراهی شما
خواهشمندم مطالب دیگر سایت را مورد مطالعه قرار دهید و حتی الامکان نظرات خودتان را اعلام فرمائید .یا در شبکه های اجتماعی اشتراک گذاری کنید.